Cerebellar Ataxia, Neuropathy, Vestibular Areflexia Syndrome 환자에서 뇌 대사감소
Brain Hypometabolism in Cerebellar Ataxia, Neuropathy, Vestibular Areflexia Syndrome
Article information
Trans Abstract
Cerebellar ataxia with neuropathy and vestibular areflexia syndrome (CANVAS) is a slowing progressive ataxic disorder characterized by bilateral vestibulopathy, cerebellar ataxia and somatosensory impairment. Autonomic dysfunction is recently considered as a core feature in CANVAS in addition to these symptoms. In most cases, patients with CANVAS show cerebellar atrophy in brain imaging, but some cases show minimal or no atrophy of cerebellum. Brain (18F)-fluoro-2-deoxy-D-glucose positron emission tomography (18F-FDG PET) study can be a complimentary tool to diagnosis CANVAS in cases of no structural abnormality such as cerebellar atrophy. Hereby, we present a case of CANVAS with minimal atrophy of cerebellum but showing a prominent hypometabolism in cerebellum, thalamus and posterior cingulate cortex in 18F-FDG PET.
서 론
Cerebellar ataxia with neuropathy and vestibular areflexia syndrome (CANVAS)는 서서히 진행하는 실조성 질환으로 양측성 전정병증, 소뇌실조, 그리고 체성감각소실과 같은 증상을 특징으로 한다[1]. 최근 보고에서는 이들 삼징후 뿐만 아니라, 자율신경부전도 CANVAS의 중요한 임상 특징이라 하였다[2]. 소뇌 실조증이 저명한 경우 대부분 뇌 영상검사에서 소뇌위축이 관찰되지만, 영상검사에서 소뇌위축이 관찰되지 않은 경우도 드물지 않게 보고 되고 있다[3]. 이러한 구조적 이상이 저명하지 않은 경우에는 (18F)-fluoro-2-deoxy-D-glucose positron emission tomography (18F-FDG PET) 같은 기능적 영상이 진단과 질병의 진행과정을 예측하는데 도움이 될 수 있다. 현재까지 국내외 논문에서 CANVAS 환자에서 뇌 18F-FDG PET 등 기능적 영상을 보고한 연구는 없었다. 이에 저자들은 자율신경부전이 저명한 CANVAS 환자에서 소뇌위축은 없었으나, 18F-FDG PET상 소뇌와 함께 시상, 뒤쪽띠다발피질(posterior cingulate cortex) 등의 부위에서 대사감소가 있었던 환자를 경험하였기에 문헌고찰과 함께 보고하고자 한다.
증 례
63세 남자환자가 진행하는 보행이상과 균형감각이상으로 내원하였다. 3년 전부터 증상이 서서히 시작되었으며, 어둡거나 바닥이 울퉁불퉁한 곳에서 더욱 심해지는 양상이었다. 증상이 점점 진행되어 자주 넘어지게 되었으며, 지팡이 보행이 필요할 정도까지 증상이 악화되었다. 과거력상 당뇨, 고혈압, 결핵 등 만성질환은 없었고, 실조 등과 관련한 가족력 또한 없었으며, 이독성 항생제 등을 사용한 기왕력도 없었다. 동반 증상으로는 기립성 어지럼과 배뇨장애, 그리고 양 발과 하지의 이상감각을 호소하였다.
신경학적 검사상 경도의 소뇌성 구음장애와 양쪽 상지의 겨냥이상과 활동떨림 소견이 관찰되었으며 롬버그 검사가 양성이었다. 심부건 반사는 상지에서는 정상이었지만, 하지에서는 저하되어 있었다. 위치감각은 상지에서는 정상이었지만, 하지에서는 저하되어 있었고, 진동감각은 상하지에서 정상이었다. 양측 발에 고추가루를 뿌려놓은 듯한 이상감각을 호소하였으며, 하지의 침통각과 온도감각이 저하되어 있었다.
안구운동검사에서 자발안진은 관찰되지 않았으나, 양측에서 수평 주시유발안진과 반동안진(rebound nystagmus)이 관찰되고(Fig. 1A), 양측 수평 원활추종운동이 손상되어 있었다 (Fig. 1B). 또한 신속안구운동(saccades)에서 외안근운동 제한이 없는 양측 수평 및 상하 수직 측정과소(hypometria)가 관찰되었다. 수평의 두부충동검사(head impulse test, HIT)에서 양측에서 따라잡기 신속안구운동(catch-up saccade)이 관찰되었으며, 비디오 두부충동검사(video HIT, vHIT)에서 양측 가쪽반고리관과 뒤쪽반고리관에서 이득(gain)이 감소하였고, 현성 신속안구운동(overt catch-up saccade)이 관찰되었다(Fig. 1C). 온도안진검사에서 양측반고리관 마비가 관찰되고(Fig. 2A), 회전의자검사에서 모든 주파수에서 이득이 감소되었으며, 경부 및 안구 전정유발근전위(vestibular-evoked myogenic potentials, VEMP)는 양측에서 모두 유발되지 않았다(Fig. 2B). 청력검사는 양측에서 고음역에서 경미하게(우측 19 dB, 좌측 30 dB) 역치가 증가되어 있었으며, 신경전도 검사에서는 양 상하지에서 운동, 감각 신경에서 정상범위를 보였다. 체성감각유발전위 검사에서도 정상 소견을 보였다. 자율신경계검사에서는 땀분비검사인 정량땀분비축삭반사검사(quantitative sudomotoraxon reflex test)에서 상지 전완부, 하지 근위부와 원위부에서 감소 소견을 보였고, 발에서는 유발되지 않았다. 교감피부반응검사(sympathetic skin reflex)에서도 양측 손에서는 피부전위가 관찰되었으나, 다리에서는 전위가 유발되지 않았다. 발살바비가 감소되어 아드레날린 기능 이상 소견을 보였으나, 기립경 검사에서는 저명한 기립성 저혈압 소견은 관찰되지 않았다. 요역동학 검사에서 배뇨근 저활동성(detrusor underactivity)의 특징을 보이는 신경인성 방광 소견을 보였다.
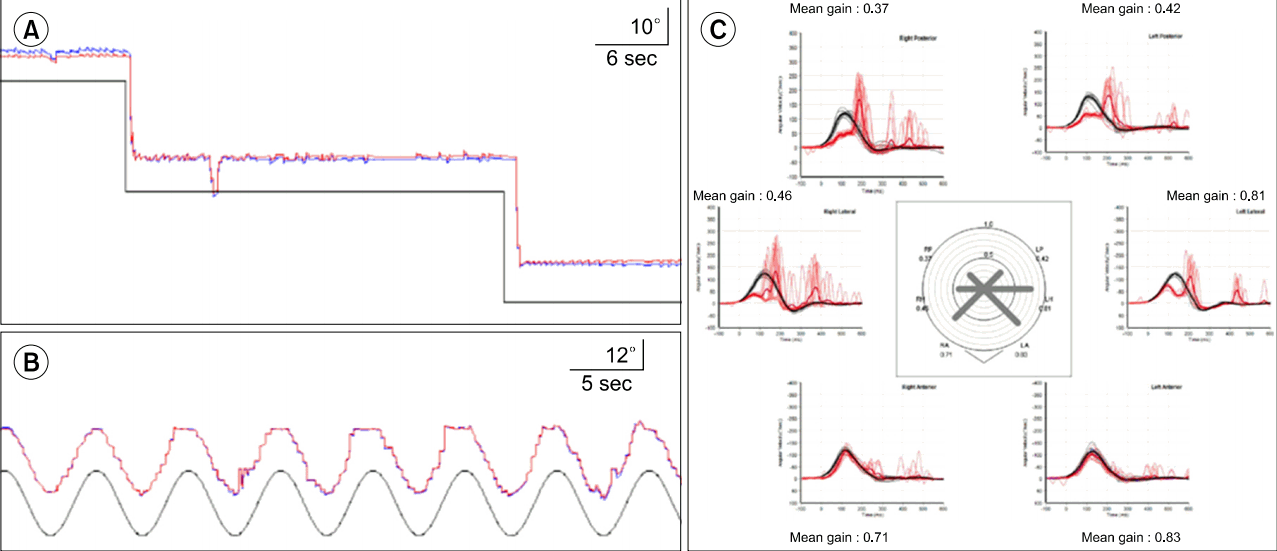
Video-oculography (VOG) and video head impulse test (vHIT) of the patient. Bilateral gaze-evoked (gaze angle: 30°) and rebound nystagmus, (A) and smooth pursuit impairment (B) were also observed. Video head impulse test (vHIT) showed decreased vestibulo-ocular reflex gain and overt catch-up saccades on bilateral horizontal and posterior canals (C).
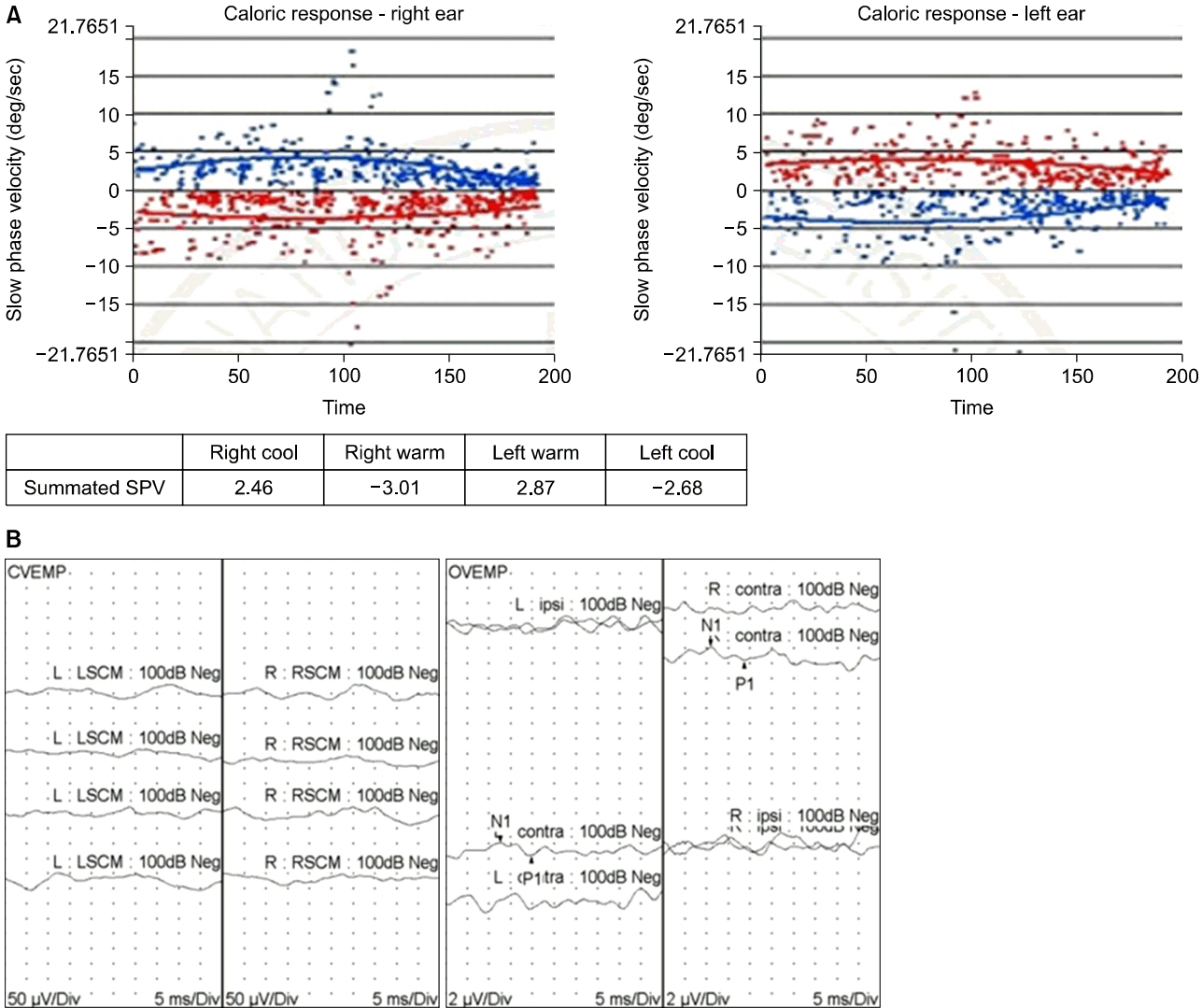
Caloric test and ocular/cervical vestibular evoked myogenic potentials (VEMPs). The caloric test showed bilateral decreased response during bithermal caloric irrigation (A). The ocular and cervical VEMPs showed no evoked potential in both ears (B). SPV, slow phase velocity; CVEMP, cervical vestibular evoked myogenic potential; OVEMP, ocular vestibular evoked myogenic potential; L, left; LSCM, left sternocleidomastoid muscle; R, right; RSCM, right sternocleidomastoid; ipsi, ipsilateral; contra, contralateral.
실조증을 보이는 유전질환 감별을 위해 spinocerebellar ataxia (SCA) 1, 2, 3, 6, 7 그리고 Friedreich ataxia 유전자검사를 시행하였으나 모두 음성이었다. 갑상선 호르몬, 비타민 B12 및 혈관염 표지자 검사는 모두 음성 소견으로 확인되었다. 뇌 magnetic resonance imaging (MRI)에서는 저명한 소뇌위축 소견은 관찰되지 않았으나(Fig. 3A), 뇌 18FDG-PET에서 양측 소뇌에서 대사감소가 관찰되었다(Fig. 3B). Statistical Parametric Mapping (SPM; http://www.fil.ion.ucl.ac.uk/spm/, 본 증례는 10명의 동일 연령대의 정상 남성 한국인을 대조군으로 하여 증례 환자에서 유의미한[p-value<0.05, uncorrected]뇌 대사감소 보인 부분을 분석하여 표기하였음) 프로그램을 이용한 분석에서도 양측 시상과 뒤쪽띠다발피질, 양측 소뇌에서 의미 있는 대사 감소 소견을 보였으며, 특히 소뇌우측 다리 1에서 의미 있는 대사 감소 소견을 보였다(Fig. 3C).

Brain magnetic resonance imaging (MRI) and 18F-FDG PET of the patient. The MRI showed no prominent cerebellar atrophy (A). 18F-FDG PET showed hypometabolism in both cerebellum (B). SPM analysis revealed hypometabolism involving both cerebellum, especially in right crus I area (blank arrows), both thalami (triangles) and posterior cingulate cortices (arrows) (C). 18F-FDG PET, (18F)-fluoro-2-deoxy-D-glucose positron emission tomography; SPM, statistical parametric mapping.
소견을 종합하면 소뇌실조증과 저명한 양측 전정신경병증, 그리고 하지의 세신경섬유병증(small fiber neuropathy), 자율신경부전을 보여 CANVAS로 진단할 수 있었고, 소뇌다리와 시상, 뒤쪽띠다발피질 영역에서 대사저하 소견을 확인하였으며 꾸준한 재활치료를 계획하고 퇴원하였다.
고 찰
Bronstein 등이 1990년대에 청력이 보존되는 양측 전정병과 소뇌 실조를 특징으로 하는 환자군을 처음으로 보고 하였고[3], 이후 이들 환자군에서 말초신경병이 자주 동반 되는 것이 밝혀짐에 따라 이러한 질환 그룹을 CANVAS라고 명명하게 되었다[3]. CANVAS는 균형유지에 중요한 기관들인 소뇌, 고유감각, 전정계 등이 다계통으로 손상되는 질환으로 병리소견상 선택적인 감각 신경절병(selective sensory ganglionopathy)을 보인다. 전정신경, 얼굴신경, 삼차신경을 침범하지만, 와우신경(cochlear nerve) 및 달팽이신경절(spiral ganglion)은 특징적으로 보존되는 것으로 알려졌다[4]. 양측 전정병증으로 인해 전정안구반사 이득(vestibulo-ocular reflex gain, VOR gain)이 양측으로 감소된다. 또한 전정안구반사, 원활추종운동 그리고 시운동반사(optokinetic reflex)의 3가지 눈운동 반사의 손상으로 인한 시각전정안구반사(visually enhanced vestibulo-ocular reflex)의 손상이 나타난다. 소뇌 기능저하로 소뇌성 구음장애, 사지 실조(limb ataxia), 주시유발안진 등이 나타날 수 있다. 감각신경손상으로 촉각, 침통각, 진동 혹은 위치감각 이상의 감각신경병증이 나타난다. CANVAS의 증상 발생시점에 따라서 다양한 임상양상이 발현될 수 있으며, 실조증을 보이기 때문에 척수소뇌실조(SCA) 및 Friedreich’s ataxia와의 감별을 위해 유전자검사가 필요하다[1].
또한 최근 자율신경부전이 CANVAS의 핵심 증상으로 보고되고 있다. Wu 등[2]은 26명의 CANVAS 환자를 대상으로 자율신경기능을 평가하였고, 대표적인 증상으로 땀이 감소하고 차가운 발, 발기부전, 현기증(lightheadedness), 지속적인 변비, 소변장애 등의 자율신경부전 증상을 보고하였다. 본 증례에서도 기립성 어지럼, 신경인성방광 등과 동반한 자율신경 부전 증상과 함께, 자율신경검사상 아드레날린 기능 이상과 광범위한 신경절후 땀분비 이상을 보였으며, 요역동학적 검사상 배뇨근 저하에 의한 신경인성방광을 보였다. 당뇨 등의 기저질환 없이 자율신경부전을 설명할 만한 다른 질환이 없는 상태로 CANVAS로 인한 자율신경부전으로 보는 것이 합당할 것으로 생각된다. 이렇게 자율신경부전이 있는 경우에는 다계통위축증-소뇌형(multiple systemic atrophy-cerebellar type, MSA-C)와의 감별도 각별히 주의해야 하겠다. MSA-C는 파킨슨 증상이 동반되며, CANVAS와 마찬가지로 소뇌위축이 관찰될 수 있지만, 교뇌위축이 같이 동반되어 있는 점이 차이점이며, 전정병증이 없고, 감각신경이상을 동반되지 않는 점이 또한 CANVAS와 감별점이라 할 수 있다[3].
Szmulewicz 등[3]은 27명의 CANVAS를 대상으로 한 연구에서 22명에서 MRI상 소뇌위축이 관찰되었고, 5명은 저명한 위축 소견이 관찰되지 않았음을 보고하였다. 소뇌위축은 특징적으로 앞등쪽충부에 해당하는 충부 소엽 VI, VIIa와 VIIb과, 가측에서는 다리 1 (crus I)에 해당되는 부위에서 관찰되었다. 본 증례는 소뇌성 구음장애 및 실조 등의 증상을 보였지만 뇌 MRI 에서 소뇌위축은 없었다. 하지만, 18F-FDG PET에서 양측 소뇌와 우측 다리 1, 시상영역에서 의미 있는 대사저하 소견이 관찰되는 특징이 있다. 다른 실조성 질환인 척수소뇌 실조증(SCA) 같은 경우에도 FDG-PET 등 기능적 영상을 이용하여 진단의 보조도구로 시도되고 있다. SCA 2에서는 소뇌, 교뇌, 해마곁이랑에서 대사저하 소견을 보였고, SCA 3에서는 소뇌, 해마곁이랑, 렌즈핵에서 대사저하를 보이며, SCA 6에서는 주로 소뇌와 전두엽 피질의 대사저하 소견이 보인다[5]. 이는 본 증례 CANVAS 와는 다른 패턴이다.
본 증례는 CANVAS 환자로서 전형적인 증상 외에 자율신경부전이 핵심 증상으로 보였으며 뇌 MRI는 정상이지만 양측 소뇌 특히 다리 1, 시상의 대사저하 소견은 다른 소뇌 실조증 환자와 구분되는 CANVAS 환자의 특징일 수 있겠다. 소뇌다리 1의 특징적인 대사감소는 앞서 기술한 Szmulewicz등[3]의 연구의 다리 1 영역의 위축과도 일치하여 의미가 있을 수 있겠다. CANVAS 환자의 기능영상 소견은 첫 증례보고이며 향후 더 많은 CANVAS환자에서 18F-FDG PET 등 기능영상에 대한 경험을 축적하여 진단의 보조도구로 이용되고, 이러한 영상이 더 나아가 질병의 병인을 이해하는데 도움이 될 것을 기대해 본다.
Notes
No potential conflict of interest relevant to this article was reported.