Articles
- Page Path
- HOME > Res Vestib Sci > Volume 17(4); 2018 > Article
-
Original Article
급성저혈압에 의한 내측전정신경핵 신경세포의 흥분성 변화를 분석하기 위한 테트로드 기법의 적용 -
김영1, 구호2,3, 박병림3, 문세진3, 양승범4, 김민선3

- Application of Tetrode Technology for Analysis of Changes in Neural Excitability of Medial Vestibular Nucleus by Acute Arterial Hypotension
-
Young Kim1, Ho Koo2,3, Byung Rim Park3, Se Jin Moon3, Seung-Bum Yang4, Min Sun Kim3

-
Research in Vestibular Science 2018;17(4):142-151.
DOI: https://doi.org/10.21790/rvs.2018.17.4.142
Published online: December 21, 2018
1Department of Emergency Medicine, Wonkwang University School of Medicine & Hospital, Iksan, Korea
2Institute of Brain Science, Wonkwang University School of Medicine, Iksan, Korea
3Department of Physiology, Wonkwang University School of Medicine, Iksan, Korea
4Department of Medical Non-commissioned Officer, Wonkwang Health Science University, Iksan, Korea
- Corresponding Author: Min Sun Kim Department of Physiology, Wonkwang University School of Medicine, 460 Iksan dae-ro, Iksan 54538, Korea Tel: +82-63-850-6779 Fax: +82-63-852-6108 E-mail: mskim@wku.ac.kr
• Received: September 16, 2018 • Revised: October 24, 2018 • Accepted: October 24, 2018
Copyright © 2018 by The Korean Balance Society. All rights reserved.
This is an open access article distributed under the terms of the Creative Commons Attribution Non-Commercial License (http://creativecommons.org/licenses/by-nc/4.0) which permits unrestricted non-commercial use, distribution, and reproduction in any medium, provided the original work is properly cited.
- 5,729 Views
- 53 Download
Abstract
-
Objectives
- Excitability o medial vestibular nucleus (MVN) in the brainstem can be affected by changes in the arterial blood pressure. Several animal studies have demonstrated that acute hypotension results in the alteration of multiunit activities and expression of cFos protein in the MVN. In the field of extracellular electrophysiological recording, tetrode technology and spike sorting algorithms can easily identify single unit activity from multiunit activities in the brain. However, detailed properties of electrophysiological changes in single unit of the MVN during acute hypotension have been unknown.
-
Methods
- Therefore, we applied tetrode techniques and electrophysiological characterization methods to know the effect of acute hypotension on single unit activities of the MVN of rats.
-
Results
- Twoor3typesofunitcouldbeclassifiedaccordingtothemorphologyofspikes and firing properties of neurons. Acute hypotension elicited 4 types of changes in spontaneous firing of single unit in the MVN. Most of these neurons showed excitatory responses for about within 1 minute after the induction of acute hypotension and then returned to the baseline activity 10 minutes after the injection of sodium nitroprusside. There was also gradual increase in spontaneous firing in some units. In contrast small proportion of units showed rapid reduction of firing rate just after acute hypotension.
-
Conclusions
- Therefore, application of tetrode technology and spike sorting algorithms is another method for the monitoring of electrical activity of vestibular nuclear during acute hypotension.
서 론
대상 및 방법
1) 실험 동물
2) 혈압측정 및 저혈압유발
1) Spike 분류 및 군집화(spike sorting & clustering)
2) Spike의 전기생리학적 특성화
결 과
고 찰
결 론
Acknowledgments
Fig. 1.Histologic verification for the location of tetrode electrode in the medial vestibular nucleus (MVN). (A) A photograph presents
the location of electrolytic lesion (arrow) indicating tip of tetrode in the MVN. (B) Schematic drawing shows regional distribution of recording site at the MVN of 7 rats. CB, cerebellum.
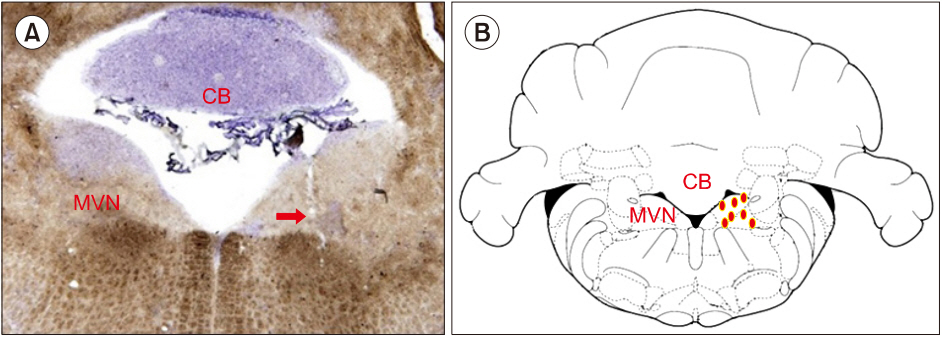

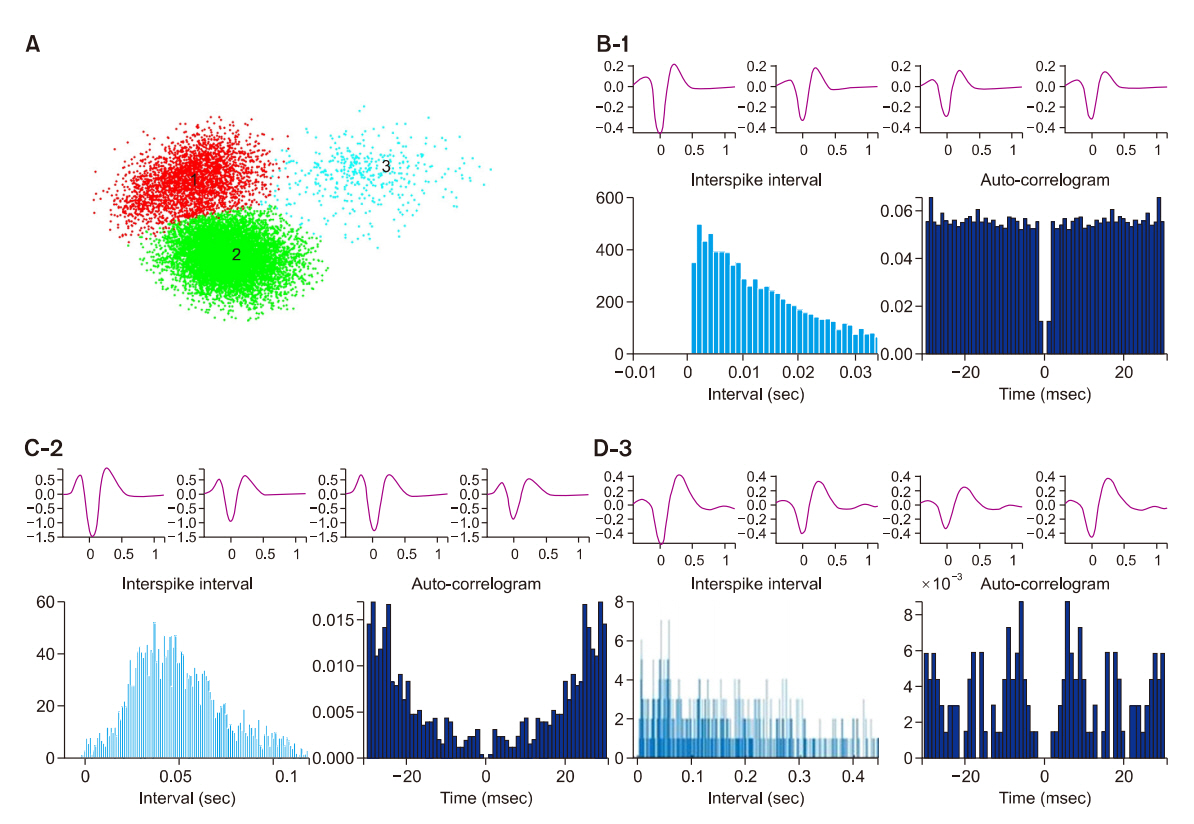
Fig. 2.Classification of spikes in the medial vestibular nucleus. (A) Spike sorting by principal component analysis and K-mean method that was used to separate single neurons (unit) from multiunits. Three units (1, 2, 3) were well isolated after the spike sorting. (B-1, C-2, D-3) Upper panel, 4 different shapes of each spike recorded from single tetrode electrode. Lower panel, different excitation patterns revealed by interspike interval histogram and auto-correlogram in each unit.


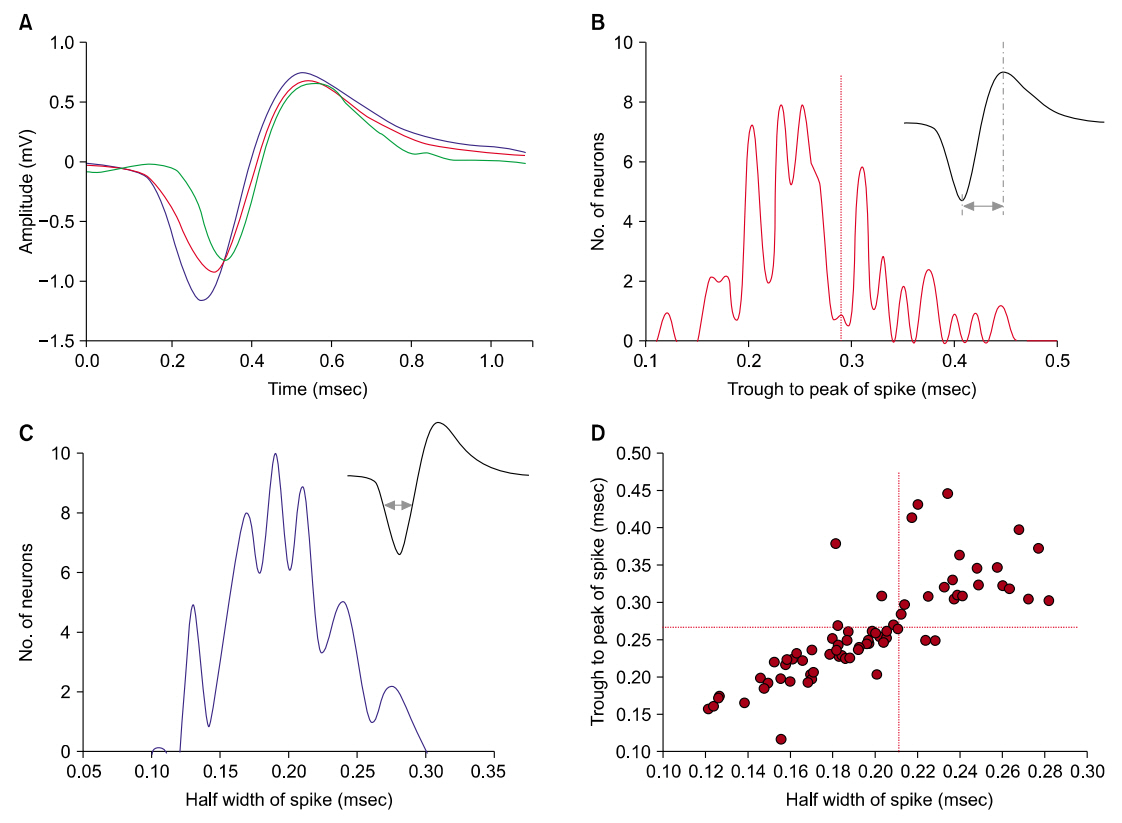
Fig. 3.Electrophysiological characterization of spikes in the medial vestibular nucleus. (A) Typical 3 different wave forms of multiunit spikes that were already sorted by principal component analysis. Once sorted, the waveforms of spike can be averaged to yield values of the waveform half-width and the trough-to-peak time. (B) Plot of trough-to-peak time by the number of neurons. The plot appears to have some bimodality. (C) Plot of half width time of spike by the number of neurons. The plot appears to have single modality. (D) Scatter plot of all peak-to-peak times and half-widths for each individual neuron. This plot indicates bimodal distribution of spikes (n=77).
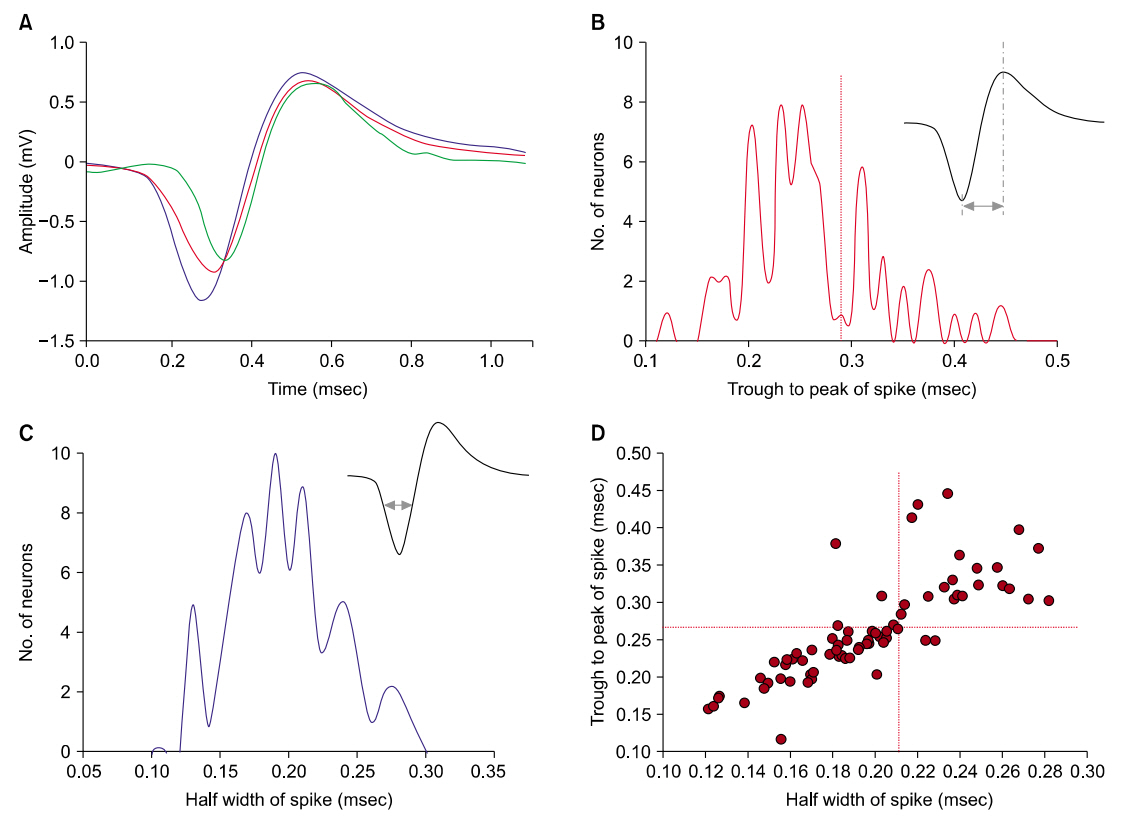

Fig. 4.Representative recordings for simultaneous changes in spontaneous firing of 3 different units following intravenous injection of sodium nitroprusside (10 μ g/kg). (A) Changes in arterial blood pressure
(ABP). Treatment of nitroprusside caused about 30% of reduction of baseline value in ABP. (B1–3) Changes in firing rate of 3 different units. (C) Changes in shape of spikes following acute hypotension. There is a significant reduction in amplitude of large-sized spike following acute arterial hypotension.
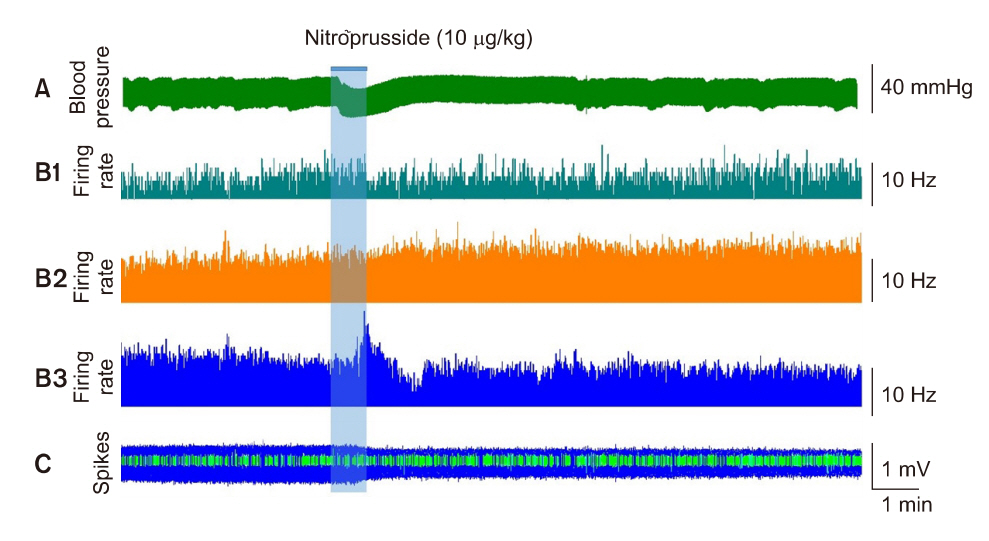

Fig. 5.Summary of changes in spontaneous firing activity of medial vestibular nucleus (MVN) neurons following acute arterial hypotension. (A) Time-dependent changes in firing rate of total 20 MVN neurons of 5 rats following acute arterial hypotension. (B) Time-dependent changes in mean firing rate of upregulation group (red) and down regulation group (blue) that showed increase and decrease in firing activity, respectively. Values are mean±standard deviation of upregulation group (n=13) and of down regulation group (n=4), respectively. (C) Histograph presents 4 types of responsiveness in spontaneous firing by number of neurons following acute arterial hypotension.


- 1. Newman-Toker DE, Dy FJ, Stanton VA, Zee DS, Calkins H, Robinson KA. How often is dizziness from primary cardiovascular disease true vertigo? A systematic review. J Gen Intern Med 2008;23:2087–94.ArticlePubMedPMC
- 2. Ohashi N, Imamura J, Nakagawa H, Mizukoshi K. Blood pressure abnormalities as background roles for vertigo, dizziness and disequilibrium. ORL J Otorhinolaryngol Relat Spec 1990;52:355–9.ArticlePubMed
- 3. Jeon EJ, Park YS, Park SN, Park KH, Kim DH, Nam IC, et al. Clinical significance of orthostatic dizziness in the diagnosis of benign paroxysmal positional vertigo and orthostatic intolerance. Am J Otolaryngol 2013;34:471–6.ArticlePubMed
- 4. Newman-Toker DE, Camargo CA Jr. 'Cardiogenic vertigo'--true vertigo as the presenting manifestation of primary cardiac disease. Nat Clin Pract Neurol 2006;2:167–72.ArticlePubMedPDF
- 5. Choi JH, Seo JD, Kim MJ, Choi BY, Choi YR, Cho BM, et al. Vertigo and nystagmus in orthostatic hypotension. Eur J Neurol 2015;22:648–55.ArticlePubMed
- 6. Kim MS, Hyo Kim J, Kry D, Ae Choi M, Ok Choi D, Gon Cho B, et al. Effects of acute hypotension on expression of cFos-like protein in the vestibular nuclei of rats. Brain Res 2003;962:111–21.ArticlePubMed
- 7. Kim MS, Choi DO, Choi MA, Kim JH, Kim KY, Lee MY, et al. Immunohistochemical detection of phosphorylated form of extracellular signal-regulated kinase 1/2 in rat vestibular nuclei following hemorrhagic hypotension. Neurosci Lett 2004;360:49–52.ArticlePubMed
- 8. Park BR, Kim MS, Kim JH, Jin YZ. Effects of acute hypotension on neuronal activity in the medial vestibular nuclei of rats. Neuroreport 2001;12:3821–4.ArticlePubMed
- 9. Gray CM, Maldonado PE, Wilson M, McNaughton B. Tetrodes markedly improve the reliability and yield of multiple single-unit isolation from multi-unit recordings in cat striate cortex. J Neurosci Methods 1995;63:43–54.ArticlePubMed
- 10. Mechler F, Victor JD, Ohiorhenuan I, Schmid AM, Hu Q. Three-dimensional localization of neurons in cortical tetrode recordings. J Neurophysiol 2011;106:828–48.ArticlePubMedPMC
- 11. Lefebvre B, Yger P, Marre O. Recent progress in multi-electrode spike sorting methods. J Physiol Paris 2016;110(4 Pt A):327–35.ArticlePubMed
- 12. Santos L, Opris I, Fuqua J, Hampson RE, Deadwyler SA. A novel tetrode microdrive for simultaneous multi-neuron recording from different regions of primate brain. J Neurosci Methods 2012;205:368–74.ArticlePubMedPMC
- 13. Maurer AP, Cowen SL, Burke SN, Barnes CA, McNaughton BL. Phase precession in hippocampal interneurons showing strong functional coupling to individual pyramidal cells. J Neurosci 2006;26:13485–92.ArticlePubMedPMC
- 14. Ferguson JE, Boldt C, Redish AD. Creating low-impedance tetrodes by electroplating with additives. Sens Actuators A Phys 2009;156:388–93.ArticlePubMedPMC
- 15. Paxinos G, Watson C. The rat brain in stereotaxic coordinates. 6th ed. New York: Academic Press; 2007.
- 16. Murofushi T, Curthoys IS, Gilchrist DP. Response of guinea pig vestibular nucleus neurons to clicks. Exp Brain Res 1996;111:149–52.ArticlePubMed
- 17. Sun Y, Waller HJ, Godfrey DA, Rubin AM. Spontaneous activity in rat vestibular nuclei in brain slices and effects of acetylcholine agonists and antagonists. Brain Res 2002;934:58–68.ArticlePubMed
- 18. Courjon JH, Precht W, Sirkin DW. Vestibular nerve and nuclei unit responses and eye movement responses to repetitive galvanic stimulation of the labyrinth in the rat. Exp Brain Res 1987;66:41–8.ArticlePubMed
- 19. Pettersen KH, Einevoll GT. Amplitude variability and extracellular low-pass filtering of neuronal spikes. Biophys J 2008;94:784–802.ArticlePubMedPMC
- 20. Stratton P, Cheung A, Wiles J, Kiyatkin E, Sah P, Windels F. Action potential waveform variability limits multi-unit separation in freely behaving rats. PLoS One 2012;7:e38482.ArticlePubMedPMC
- 21. Precht W, Shimazu H. Functional connections of tonic and kinetic vestibular neurons with primary vestibular afferents. J Neurophysiol 1965;28:1014–28.ArticlePubMed
- 22. Ayyildiz M, Kozan R, Agar E, Kaplan S. Sexual dimorphism in the medial vestibular nucleus of adult rats: stereological study. Anat Sci Int 2008;83:131–9.ArticlePubMed
- 23. Moore JJ, Ravassard PM, Ho D, Acharya L, Kees AL, Vuong C, et al. Dynamics of cortical dendritic membrane potential and spikes in freely behaving rats. Science 2017;355(6331):pii: eaaj1497. https://doi.org/10.1126/science.aaj1497.Article
- 24. du Lac S, Lisberger SG. Membrane and firing properties of avian medial vestibular nucleus neurons in vitro. J Comp Physiol A 1995;176:641–51.ArticlePubMed
- 25. Serafin M, de Waele C, Khateb A, Vidal PP, Mühlethaler M. Medial vestibular nucleus in the guinea-pig. I. Intrinsic membrane properties in brainstem slices. Exp Brain Res 1991;84:417–25.ArticlePubMed
- 26. Takazawa T, Saito Y, Tsuzuki K, Ozawa S. Membrane and firing properties of glutamatergic and GABAergic neurons in the rat medial vestibular nucleus. J Neurophysiol 2004;92:3106–20.ArticlePubMed
- 27. Bagnall MW, Stevens RJ, du Lac S. Transgenic mouse lines subdivide medial vestibular nucleus neurons into discrete, neurochemically distinct populations. J Neurosci 2007;27:2318–30.ArticlePubMedPMC
- 28. Henze DA, Borhegyi Z, Csicsvari J, Mamiya A, Harris KD, Buzsáki G. Intracellular features predicted by extracellular recordings in the hippocampus in vivo. J Neurophysiol 2000;84:390–400.ArticlePubMed
- 29. Patil GD, Briski KP. Lactate is a critical "sensed" variable in caudal hindbrain monitoring of CNS metabolic stasis. Am J Physiol Regul Integr Comp Physiol 2005;289:R1777–86.ArticlePubMed
- 30. Luyten WH, Sharp FR, Ryan AF. Regional differences of brain glucose metabolic compensation after unilateral labyrinthectomy in rats: a [14C]2-deoxyglucose study. Brain Res 1986;373:68–80.ArticlePubMed
REFERENCES
Figure & Data
References
Citations
Citations to this article as recorded by 

- Figure
- We recommend
- Related articles
-
- Application of tetrode technology for analysis of changes in neural excitability of medial vestibular nucleus by acute arterial hypotension.
- Induction of mRNA Transcripts for Immediate-Early Genes in Vestibular Ganglion Following Acute Arterial Hypotension
- Expression of Glutamate Receptors in the Medial Vestibular Nuclei following Acute Hypotension
- Expression of Metabotropic Glutamate Receptors in the Medial Vestibular Nucleus Following Acute Hypotension in Rats

 KBS
KBS
 PubReader
PubReader ePub Link
ePub Link Cite
Cite